2015-10-08 10:10 作者:cnbeta网站(台州)
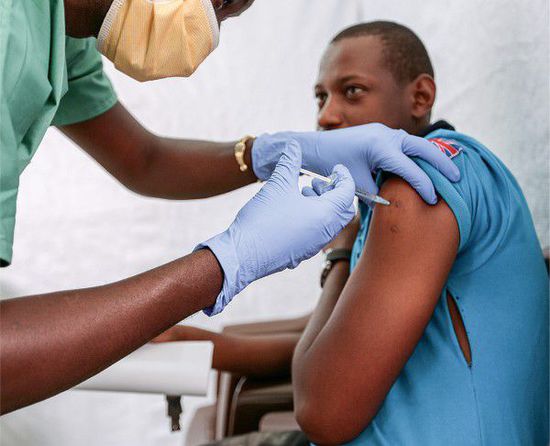
摘要:有史以来,没有哪个疫苗像默克公司生产的埃博拉疫苗一样如此迅速地向前发展。从去年秋天第一个人接种该疫苗,到9个月之后的今年7月,一个不同寻常的临床试验在几内亚几乎令人无法相信的条件下进行——偏远山村、研究人员的质疑、案例稀少。无论如何,结果证明,这种疫苗确实有效,而且,预计效果为74.7%~100%。
有人认为,默克公司的疫苗或许能帮助几内亚控制疫情,而且,在目前开展的相关试验的延伸试验中,它也被用于塞拉利昂。
但这种显著功效能否转化成压制下一次爆发的急需疫苗库存?答案将取决于研发者能否说服美国食品药品监督管理局(FDA)等管理机构相信,他们的疫苗足够安全和有效,能大规模使用。默克公司的疫苗和由葛兰素史克(英国制药公司)生产的另一种疫苗,虽然前景广阔,但尚未在传统临床试验中证明自己,因此也面临多重障碍。
有关默克公司疫苗测试的决定最早在2014年10月作出,但直到今年3月才开始真正起步。而当时的埃博拉病人数量已经在逐渐减少,并且他们分散在几内亚的一大片区域中。研究人员选择了一种被称为“包围接种”的方案——曾在上世纪70年代用于清除天花,即为埃博拉患者的家人、邻居、朋友等接触者接种疫苗,在患者周围形成“保护圈”,保护接触对象并阻断病毒进一步传播。
试验中,接触圈内的对象被随机分为两组,一组立即接种疫苗,一组延迟3周后接种。目前初步结果显示,2014名立即接种者在接种10天后没有人感染埃博拉病毒,2380名延缓接种者中,16人感染埃博拉病毒。
但该疫苗项目负责人Mark Feinberg承认,这种非常规的临床试验可能无法产生足够的数据说服管理部门。而且随着疫情的减弱,很难收集足够的有效数据。在经历了可怕的22个月、2.8万感染病例和11291例死亡病例后,利比里亚正式宣布摆脱了埃博拉疫情,而且在9月6日,几内亚和塞拉利昂也各仅有1例病例。
FDA代理首席科学家Luciana Borio表示,未来还会出现埃博拉疫情暴发,因此应确保相关疫苗的优先权,批准一种疫苗,以便尽快储备和部署。“研发一种被证明有效且安全的埃博拉疫苗将是一个里程碑。”Borio说,该机构将迅速对各制药公司提交的候选疫苗进行审查。但无论是默克公司还是葛兰素史克公司均未向FDA或其他国家的重要监管部门提出申请。这两家公司正在收集更多的人体和动物实验数据,希望能在申请中获得优势。
默克公司的疫苗最初由加拿大公共卫生局的研究人员开发出来,包含有能够在牲畜而非人类中导致疾病的水疱性口炎病毒(VSV),该病毒能够与埃博拉病毒表面蛋白绑定在一起。后来,加拿大政府将疫苗执照发放给NewLink Genetics公司。但该公司一直未能有所突破。去年11月,NewLink Genetics公司将疫苗许可转让给默克公司。
在该疫苗迅速通过安全性试验后,世卫组织就开始了不同寻常的“包围接种”试验,但该疫苗从未进行临床试验。如果相关实验数据不够充足,无法获得FDA的标准有效性许可,默克公司将继续两个替代审批流程中的一个:药物或疫苗主要用于“严重或危及生命的情况”,其实用性或伦理结论可能无法达到传统的有效性要求。而且,葛兰素史克公司也将采取这种途径。
美国马里兰州贝塞斯达市国家过敏症与传染病研究所与葛兰素史克公司共同开发了另一种疫苗。该疫苗源自能够引发感冒的黑猩猩腺病毒,研究人员使其表达了来自两种埃博拉病毒的蛋白质(分别源自扎伊尔和苏丹)。研究显示,疫苗注射在所有志愿者体内都没有产生严重副作用。
虽然这两种疫苗已经满足动物效应法规:它们被证明对人类是安全的,并能在接种过该疫苗的猴子被注射病毒“挑战”免疫系统时保护它们。但如果一种疫苗符合加速审批要求,FDA将不会考虑动物效应法规。葛兰素史克公司埃博拉疫苗项目主管Ripley Ballou则指出,由于加速审批通常被用于药品而非疫苗,因此当FDA在5月对其进行讨论时,实际是“打开了绿色通道”。“我不认为之前有人能想到会是这样。”
事实上,加速审批要求研究人员确定何种免疫应答保护了接种疫苗的猴子,然后表明该产品也能触发人体出现类似的免疫应答。但葛兰素史克公司和默克公司的疫苗在猴子实验中100%有效,这让研究人员很难梳理有效性背后的免疫机制。为了找出相关免疫力,这两家公司目前在降低为猴子接种的疫苗剂量,这样在理论上能揭示疫苗成败间的免疫断点。
无论如何,FDA表示仍将为候选疫苗敞开大门。“这些方法每个都具有不确定性。”Borio说。但如果这些公司获得许可,FDA将要求它们在下一次疫情暴发中进行售后研究。据世卫组织称,今年终结疫情的目标“非常有可能实现”,但从历史上看,半数出现过埃博拉出血热疫情的国家会在疫情结束后的两年内再次暴发疫情。因此,西非国家与国际合作伙伴必须保持警惕。